Prix de VOLTARENPLAST 1 %, emplâtre médicamenteux
ANSM - Mis à jour le : 16/06/2022
VOLTARENPLAST 1%, emplâtre médicamenteuxdiclofénac sodique Veuillez lire attentivement cette notice avant d'utiliser ce médicament car elle contient des informations importantes pour vous.Vous devez toujours utiliser ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin, ou votre pharmacien.
- Gardez cette notice, vous pourriez avoir besoin de la relire.
- Adressez-vous à votre pharmacien pour tout conseil ou information.
- Si vous ressentez l'un des effets indésirables, parlez-en à votre médecin, ou votre pharmacien. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
- Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien après 3 jours.
1. Qu'est-ce que VOLTARENPLAST 1%, emplâtre médicamenteux et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser VOLTARENPLAST 1%, emplâtre médicamenteux ?
3. Comment utiliser VOLTARENPLAST 1%, emplâtre médicamenteux ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver VOLTARENPLAST 1%, emplâtre médicamenteux ?
6. Contenu de l'emballage et autres informations.
1. QU'EST-CE QUE VOLTARENPLAST 1%, emplâtre médicamenteux ET DANS QUELS CAS EST-IL UTILISE ?
VOLTARENPLAST 1%, emplâtre médicamenteux est utilisé dans le traitement local de courte durée en cas de traumatismes bénins douloureux : foulures, entorses ou contusions.
Pour application cutanée uniquement.
N'utilisez jamais VOLTARENPLAST 1%, emplâtre médicamenteux :- si vous êtes allergique au diclofénac, au propylèneglycol, au butylhydroxytoluène ou à l'un des autres composants contenus dans ce médicament (voir rubrique 6),
- si vous êtes allergique à d'autres médicaments anti-inflammatoires non stéroïdiens (AINS), comme l'acide acétylsalicylique ou l'ibuprofène,
- en cas d'antécédents d'asthme, de réaction cutanée ou de renflements à l'intérieur du nez provoquant une irritation faisant suite à la prise d'acide acétylsalicylique ou d'autres AINS,
- si vous êtes atteint d'un ulcère digestif en évolution,
- sur des plaies cutanées quelle que soit la plaie (par exemple écorchures, coupures, brûlures), dermatite exsudative, des lésions cutanées infectées ou des lésions d'eczéma,
- pendant les trois derniers mois de la grossesse,
- chez l'enfant et l'adolescent de moins de 16 ans.
- Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d'utiliser VOLTARENPLAST 1%, emplâtre médicamenteux
- Si vous êtes atteint ou avez été atteint d'asthme ou d'allergies, l'utilisation de ce médicament risque d'entraîner un spasme des muscles bronchiques (bronchospasme), pouvant causer des difficultés pour respirer.
- L'apparition d'une éruption cutanée après application impose l'arrêt immédiat du traitement.
- en cas de maladie rénale, cardiaque ou hépatique, en cas d'antécédents ou d'atteinte d'ulcère gastro-intestinal, en cas de maladie intestinale inflammatoire ou de saignement digestif.
La survenue d'effets indésirables peut être minimisée, par l'utilisation de la dose la plus faible possible pendant la durée de traitement la plus courte possible nécessaire au soulagement des symptômes.
PRECAUTIONS IMPORTANTES :
- En cas de persistance des symptômes au delà de 3 jours, un médecin doit être consulté.
- Ne jamais appliquer l'emplâtre sur les yeux ni les muqueuses et éviter tout contact avec les yeux et les muqueuses.
- VOLTARENPLAST 1 %, emplâtre médicamenteux doit être appliqué sur une peau intacte, saine et ne doit pas être appliqué sur une plaie ou sur une blessure ouverte.
- Ne pas utiliser l'emplâtre sous pansement occlusif.
·VOLTARENPLAST 1%, emplâtre médicamenteux doit être utilisé avec précaution chez les patients âgés, qui sont davantage sujets aux effets indésirables.
Après le retrait de l'emplâtre, évitez l'exposition de la zone traitée aux rayonnements solaires (soleil ou cabines UV) pendant environ une journée, afin de réduire tout risque de photosensibilité.
Ne pas utiliser de manière simultanée, tout médicament contenant du diclofénac ou d'autres AINS, par voie orale ou locale.
Autres médicaments et VOLTARENPLAST 1%, emplâtre médicamenteuxInformez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Dans des conditions normales d'utilisation de VOLTARENPLAST 1%, emplâtre médicamenteux, la quantité de diclofénac passant dans le sang est très faible, si bien que les interactions décrites pour le diclofénac par voie orale sont peu probables.
Grossesse, allaitement et fertilitéSi vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Grossesse
Bien qu'étant rares, des anomalies ont été rapportées chez les nourrissons dont la mère avait pris des AINS durant la grossesse. Pendant les 6 premiers mois de la grossesse, VOLTARENPLAST 1%, emplâtre médicamenteux ne peut être utilisé que sur les conseils de votre médecin.
Pendant les trois derniers mois de la grossesse, il ne faut en aucun cas utiliser VOLTARENPLAST 1%, emplâtre médicamenteux en raison du risque d'augmentation des conséquences graves pour la mère et l'enfant (voir le paragraphe « N'utilisez jamais VOLTARENPLAST 1%, emplâtre médicamenteux »).
Fertilité
L'utilisation de VOLTARENPLAST 1 %, emplâtre médicamenteux n'est pas recommandée aux femmes souhaitant concevoir un enfant, ayant des difficultés à concevoir un enfant ou en cours d'investigation pour rechercher une cause d'infertilité.
Allaitement
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Le diclofénac passe en très faibles quantités dans le lait maternel. Aucune observation d'effets indésirables n'ayant été faite sur le nourrisson, il n'est généralement pas nécessaire de suspendre l'allaitement pendant une utilisation de courte durée. VOLTARENPLAST 1%, emplâtre médicamenteux ne doit toutefois jamais être appliqué directement sur les seins.
SportifsSans objet.
Conduite de véhicules et utilisation de machinesAucun effet de VOLTARENPLAST 1%, emplâtre médicamenteux sur l'aptitude à conduire des véhicules et utiliser des machines n'est attendu ou seul un effet négligeable.
VOLTARENPLAST 1%, emplâtre médicamenteux contient du propylèneglycol et du butylhydroxytoluène.Ce médicament contient 1400 mg de propylèneglycol par emplâtre médicamenteux. Le propylèneglycol (E1520) peut induire des irritations de la peau.
Le butylhydroxytoluène (E321) peut provoquer des réactions cutanées locales (par exemple : eczéma) ou une irritation des yeux et des muqueuses.
3. COMMENT UTILISER VOLTARENPLAST 1%, emplâtre médicamenteux ?
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.
La dose recommandée est :
Adultes
Appliquez un emplâtre antalgique sur la région douloureuse deux fois par jour (matin et soir). La dose maximale totale pouvant être utilisée est de deux emplâtres par jour, même s'il y a plus d'un traumatisme à traiter. Ne pas traiter plus d'une région douloureuse à la fois.
Enfants et adolescents de moins de 16 ans
Du fait de l'absence d'étude spécifique, VOLTARENPLAST 1%, emplâtre médicamenteux ne doit pas être utilisé chez l'enfant et l'adolescent de moins de 16 ans.
Personnes âgées
Ce médicament doit être utilisé avec prudence chez les patients âgés qui sont plus sujets aux effets indésirables.
Patients souffrant d'insuffisance rénale ou hépatique
Ce médicament doit être utilisé avec prudence chez les patients atteints d'insuffisance hépatique ou rénale.
Mode d'administration
A utiliser exclusivement en application sur une peau intacte et saine. Pour une application sur la peau uniquement. Ne pas appliquer lors du bain ou de la douche. Ne pas ingérer !
1. Ouvrez le sachet contenant l'emplâtre, en découpant suivant le pointillé.
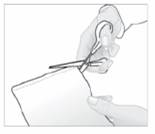
2. Extrayez un emplâtre et refermez soigneusement le sachet en appuyant sur la fermeture.

3. Retirez le film protecteur de la surface adhésive de l'emplâtre.
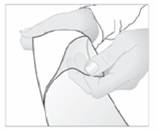
4. Ensuite, appliquez l'emplâtre sur la région douloureuse.
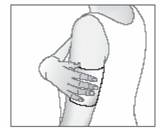
Au besoin, maintenez l'emplâtre antalgique en utilisant un filet élastique.
Ne recouvrez jamais l'emplâtre avec un pansement hermétique (occlusif).
Ne découpez jamais l'emplâtre.
Après utilisation de l'emplâtre, pliez-le en deux avec la face adhésive vers l'intérieur.
Durée du traitement
Sur la base de données limitées disponibles, un traitement d'une courte durée est recommandé.
N'utilisez jamais VOLTARENPLAST 1%, emplâtre médicamenteux pendant plus de trois jours sans consulter votre médecin. Il n'y a pas de bénéfice thérapeutique si vous utilisez VOLTARENPLAST pendant plus de 7 jours.
Chez les adolescents âgés de plus de 16 ans et les adultes, si une utilisation de plus de 7 jours est nécessaire pour soulager la douleur ou si les symptômes s'aggravent, les parents des adolescents / les patients sont invités à consulter un médecin.
Si vous avez utilisé plus de VOLTARENPLAST 1%, emplâtre médicamenteux que vous n'auriez dû :Consultez votre médecin s'il apparaît de nets effets indésirables après une utilisation incorrecte de VOLTARENPLAST ou après un surdosage accidentel (par exemple chez l'enfant). Il vous indiquera les mesures à prendre, en fonction de la gravité de l'intoxication.
Si vous oubliez d'utiliser VOLTARENPLAST 1%, emplâtre médicamenteux :Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre.
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
Consultez immédiatement votre médecin et arrêtez d'utiliser l'emplâtre si vous constatez l'un des phénomènes suivants : Eruption cutanée brutale avec démangeaisons (urticaire), gonflement des mains, des pieds, des chevilles, du visage, des lèvres, de la bouche ou de la gorge ; difficultés pour respirer ; diminution de la pression artérielle ou fatigue.
Les effets indésirables possibles sont les suivants :
Fréquents (peut toucher jusqu'à un patient traité sur 10) : réactions cutanées au site d'application, rougeur de la peau, eczéma, rougeur inflammatoire de la peau (incluant dermatite de contact et allergique), gonflement de la peau, démangeaisons et sensations de brûlure,
Peu fréquents (peut toucher jusqu'à un patient traité sur 100) : rougeur de la peau généralisée, réactions d'hypersensibilité (incluant l'urticaire), gonflement de la peau et des muqueuses et réactions allergiques généralisées.
Rare (peut toucher jusqu'à un patient traité sur 1000) : Cloques, sécheresse de la peau.
Très rare (peut toucher jusqu'à un patient traité sur 10 000) : Crise d'asthme, eczéma grave, lésion de la peau avec des pustules, lésion de la peau avec des ulcérations et sensibilité à la lumière de la peau.
Fréquence inconnue (fréquence impossible à évaluer avec les données disponibles) : hématome sur le site d'application.
Après application cutanée, l'absorption du diclofénac dans le sang et le niveau de diclofénac dans le sang sont également extrêmement faibles, comparativement aux niveaux dans le sang qui sont atteintes après la prise orale de diclofénac. Le risque d'effets indésirables touchant l'ensemble du corps (par exemple troubles gastro-intestinaux, hépatiques ou rénaux ou difficultés pour respirer) est donc très faible après une application cutanée comparativement à la fréquence des effets indésirables associés à une prise orale de diclofénac. Si le diclofénac est utilisé sur une surface étendue de la peau ou pour une durée prolongée, des effets indésirables systémiques pourraient se produire.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou votre pharmacien
Déclaration des effets secondairesSi vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s'applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
En signalant les effets indésirables, vous contribuez à fournir davantage d'informations sur la sécurité du médicament.
5. COMMENT CONSERVER VOLTARENPLAST 1%, emplâtre médicamenteux ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N'utilisez pas ce médicament après la date de péremption indiquée sur la boîte et le sachet après EXP. La date d'expiration fait référence au dernier jour de ce mois.
Conserver à une température ne dépassant pas 25ºC.
Conserver dans l'emballage extérieur d'origine, à l'abri du dessèchement et de la lumière.
Conserver le sachet hermétiquement fermé pour éviter le dessèchement.
Le médicament se conserve 4 mois après l'ouverture d'un sachet.
Ne jetez aucun médicament au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien d'éliminer les médicaments que vous n'utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. CONTENU DE L'EMBALLAGE ET AUTRES INFORMATIONS
Ce que contient VOLTARENPLAST 1%, emplâtre médicamenteux
- La substance active est :
Diclofénac sodique ............................................................................................................ 140 mg
Pour un emplâtre médicamenteux.
- Les autres composants sont :
Glycérol, propylèneglycol (E1520), adipate de di-isopropyle, sorbitol liquide cristallisable (E420), carmellose sodique, polyacrylate de sodium, copolymère basique de méthacrylate de butyle, édétate disodique, sulfite de sodium (E221), butylhydroxytoluène (E321), sulfate d'aluminium et de potassium, silice colloïdale anhydre, kaolin léger (naturel), éther laurique de macrogol, lévomenthol, acide tartrique, eau purifiée.
Qu'est-ce que VOLTARENPLAST 1%, emplâtre médicamenteux et contenu de l'emballage extérieur
VOLTARENPLAST est un emplâtre mesurant 10 cm sur 14 cm, avec une couche uniforme de pâte blanche à brun clair étalée sur un support non tissé et un film protecteur détachable.
Boîtes de 2, 5, 10 ou 14 emplâtres, dans des sachets refermables contenant 2 ou 5 emplâtres.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l'autorisation de mise sur le marché
GLAXOSMITHKLINE SANTE GRAND PUBLIC23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
Exploitant de l'autorisation de mise sur le marché
GLAXOSMITHKLINE SANTE GRAND PUBLIC23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
MERCKLE GMBHLUDWIG-MERCKLE-STRASSE 3
89143 BLAUBEUREN
ALLEMAGNE
OU
TEVA OPERATIONS POLAND SP Z.O.O.UL. MOGIMSKA 80
31-546 KRAKOW
POLOGNE
OU
SOFARIMEX-INDUSTRIA QUIMICA E FARMACEUTICA SAAV. DAS INDUSTRIAS
ALTO DE COLARIDE/ALGUALVA
2735-213 CACEM
PORTUGAL
OU
GLAXOSMITHKLINE SANTE GRAND PUBLIC23 RUE FRANCOIS JACOB
92500 RUEIL-MALMAISON
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est :
[à compléter ultérieurement par le titulaire]
< {MM/AAAA}>< {mois AAAA}.>Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l'ANSM (France).